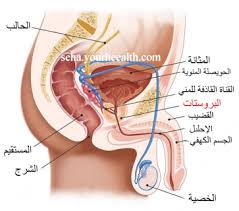
سرطان البروستات الخبيث أو سرطان الموثة بالإنجليزية Prostate Cancer هو حالة نشوء ورم سرطاني في البروستات عند الرجال وغالباً ماتكون عند المسنين في أعمار 50 سنة ومافوق .
[toc]
تعاملَ جرّاحو البولية مع حالات سرطان الموثة منذ بداية القرن العشرين، وكان الجراح Hugh Hampton Young هو أول من نشر دراسة عن استئصال الموثة الجذري بطريق عجاني، قبل الحرب العالمية الأولى، واستمرت طريقته هذه وحيدة حتى عام 1947 حيث أجرى Millin استئصال الموثة الجذري بمدخل خلف العانة.
وكان الجراح Huggins هو أوّل من نشر دراسة عام 1941 حول دور إقصاء الأندروجين في علاج سرطان الموثة المنتشر.
وأصبح هذا المرض تحدياً كبيراً لجرّاحي المسالك البولية، وجاء الكشف عن المستضد الموثي النوعي PSA في نسيج الموثة عام 1978 ليحدث ثورة في تاريخ سرطان الموثة، حيث أصبح أهم المشعرات الورمية لهذا المرض، وساهم في فهم سلوك المرض، وتطوّر هذا الفهم خلال الربع قرن الماضي وتراكمت المعلومات بغزارة عن سرطان الموثة.
وإنّ حجر الزاوية في نجاح التعامل مع هذا المرض يرتكز على الكشف المبكر، مما تطلّب تطوير هذا المشعر PSA وإيجاد معادلات تحسّن حساسية ونوعية هذا الاختبار، من حيث علاقته بحجم الموثة وعمر المريض، ونسبة أشكاله الحرة والمرتبطة، مما ساهم كثيراً في انتشار الأبحاث والدراسات المختلفة عن سرطان الموثة.
الحدوث في سرطان البروستات
تفاوت معدل الحدوث في الولايات المتحدة الأمريكية من 2.3% سنوياً في الأعوام 1985-1975 إلى 6% سنوياً في الأعوام 1995-199، وارتفع بشكل حاد بعد تطبيق فحص PSA إلى 18.4% سنوياً عام 1992-1989، واستقر على 14% سنوياً في الأعوام 1995-1992.
يُصنف سرطان الموثة عالمياً بأنه السرطان الرابع الأكثر شيوعاً عند الذكور، و معدلات الحدوث والوفاة هي أعلى في الدول الغربية عما هي في الدول النامية، والدول الاسكندنافية لديها معدل حدوث أعلى مقارنة مع جنوب أوروبا.
وفي دول أسيا خاصة الصين واليابان معدل حدوث منخفض، وكما هو الحال في الولايات المتحدة الأمريكية فقد ارتفع معدل التشخيص في باقي الدول بعد اكتشاف ال PSA وتطبيقه في التحري عن سرطان الموثة.
عوامل الخطورة في سرطان البروستات
ما تزال الأسباب النوعية لبدء وترقي سرطان الموثة غير معروفة بشكل دقيق، إلا أنه تم اقتراح عدة عوامل خطورة هي:
العمر:
يزداد احتمال حدوث سرطان الموثة كلما تقدم العمر، وهو الوحيد بين الأورام الذي لا توجد له قمة حدوث، وهو يتواجد بشكلين كامن وسريري.
- الشكل النسيجي(الكامن): يوجد عند 30% من الرجال بعمر 50 سنة، وعند 70-60% من الرجال بعمر أكبر من 80 سنة.
- الشكل السريري: يوجد عند6.1% من الرجال الأمريكيين.
مع العلم أنّ السرطان النسيجي يوجد بنفس النسبة في كل الدول والأعراق، إلّا أنّ السرطان السريري يتغير والعلاقة بينهما غير واضحة.
الوراثة:
الرجال الذين لديهم أقارب درجة أولى مصابين بسرطان الموثة يتعرّضون لضعف الخطر لتطور سرطان الموثة، ويتعلّق هذا الأمر بعمر المريض فالخطر يكون أعلى كلما كان المريض أصغر سناً.
وفي دراسة Carter 1992 بيّن أنّ النمط العائلي لسرطان الموثة يعود لاضطرابات صبغية، ويُتوقع حدوث سرطان الموثة عند 88% من الحاملين لهذه الاضطرابات مقابل 5% لغير الحاملين.
وأظهر Kapelain 1997 في دراسة واحدة أن معدل النكس أعلى في الحالات العائلية، إلّا أنّ معظم الدراسات الأخرى أظهرت نتائج متساوية.
الأندروجينات:
يتأثّر بدء وترقي سرطان الموثة بالأندروجينات ويتراجع بعد الإخصاء الطبي أو الجراحي، إلّا أنّ هناك ثلاث نقاط على دور الأندروجينات:
- يتغيّر معدل الأندروجينات الكلي خلال الفعاليات النهارية.
- من الصعب تقييم تعرّض الموثة للهرمونات الداخلية.
- من غير المعروف إذا كان التعرّض المبكر أو المتأخر للأندروجينات خلال حياة الإنسان هام، أو أن تغير التركيز هو الهام.
- نشرت نظرية مثيرة للجدل في مجلة Cancer research 1999 تدّعي أن سرطان الموثة يمكن أن يحدث نتيجة انخفاض الأندروجينات مع تقدم Prehn 1999.
- وافترض آخرون أن الاختلاف بين تركيز الأندروجينات والاستروجينات يمكن أن يكون هاماً في تطور سرطان الموثة.
عامل النمو المشابه للأنسولين-1 Insulin like growth factor-1:
ويُعرف اختصاراً ب(ILGF1) والذي يحرّض انقسام ظهارة الموثة الطبيعية والمتحولة، وربطت ثلاث دراسات بين مستويات ILGF1 وسرطان الموثة، إلا أنه من غير المعروف سبب ارتفاع ILGF1 عند بعض الأشخاص، وعزاه البعض لتعدد صبغياتILGF1.
الغذاء:
الدليل المقنع على تأثير الغذاء هو ازدياد حدوث سرطان الموثة لدى المهاجرين الأوائل من الصين واليابان.
وبشكل جزئي يفترض أن الغذاء يلعب دوراً في تحول السرطان الكامن إلى سرطان سريري، وبالتالي يلعب الغذاء دوراً في تحفيز السرطان أكثر من بدءه.
الدسم: (اللحم ومشتقات اللبن):
هناك دراسات عديدة تثبت أنّ زيادة استهلاك الدسم تؤدي إلى زيادة كلاً من حدوث السرطان والوفيات الناجمة عنه، وبالعكس فإن الغذاء الفقير بالدسم ينقص حدوث سرطان الموثة، ويؤثر الدسم عبر العوامل التالية:
- زيادة التستسترون.
- مخزن للجذور الحرة.
- تستقلب الى عوامل مسرطنة.
و بالمقابل فشلت دراسات عديدة في اظهار العلاقة بين الدسم و سرطان الموثة.
الكالسيوم:
تترافق زيادة استهلاك الكالسيوم مع زيادة حدوث سرطان الموثة، والآلية غير معروفة، ويفترض أنّ زيادة الكالسيوم تنقص تنظيم vit D، مما يحفز تكاثر خلايا الموثة.
Lycopene:
وهو مكوّن شبه كاروتيني يلعب دور مضاد تأكسد قوي، وأظهرت دراسات عديدة أنّ زيادة تناوله تنقص معدل حدوث سرطان الموثة.
Vit E:
مضاد تأكسد، تنقص زيادة تناوله معدل حدوث سرطان الموثة.
الشاي الأخضر:
يحوي مضادات تأكسد، وتناوله شائع في جنوب آسيا.
زيت الصويا:
يتألف من مواد تملك فعالية استروجينية ضعيفة، وبالتالي ينقص معدل حدوث سرطان الموثة وهو شائع التناول في آسيا.
قطع الأسهر Vasectomy:
بينت بعض الدراسات ازدياد معدل حدوث سرطان الموثة مع قطع الأسهر، وفشلت دراسات أخرى في إظهار ذلك، وتقول بعض الدراسات بأنه يعتمد على العمر الذي أجري فيه قطع الأسهر، فكلّما كان العمر أصغر فالخطر أكبر، والآلية غير معروفة، حيث تتهم عوامل عديدة مثل أضداد النطاف ومفرزات الموثة، أو أنّ المريض سوف يتابع من قبل طبيب البولية مما يزيد من احتمال كشف سرطان الموثة.
التعرض المحيطي:
التدخين:
دوره لم يؤكد.
زيادة تناول الكحول:
تؤدي لزيادة المنتجات الاستروجينية وبالتالي قد يكون له دور واقٍ من سرطان الموثة، إلا أن ذلك لم يؤكد أيضاً.
الفعالية الجنسية:
يتهم البعض زيادة الفعالية الجنسية أو تعدد الشريكات، إلا أن ذلك لم يؤكد أيضاً.
الطول والوزن:
كونهما يرتبطان مع ILGF1 فتترافق زيادة الطول والوزن مع زيادة ILGF1 وبالتالي زيادة احتمال حدوث السرطان.
التشريح المرضي لسرطان البروستات
التنشؤ داخل الظهارية الموثية (PIN):
هو مرحلة ما قبل السرطان الغازي، وله نفس الخصائص الخلوية لسرطان الموثة، ولكن لا تغيب فيه طبقة الخلايا القاعدية.
يصنف PIN الى منخفض الدرجة LG وعالي الدرجة HG، فيجب ألا يوجد PIN LG في تقارير التشريح المرضي بشكل روتيني، لأن المشرح المرضي لا يستطيع مبدئياً تمييز BPH عن PIN HG، وعند وجوده فلا يزيد خطر وجود سرطان الموثة عند إعادة الخزعة لدى المريض.
يتراوح معدل وجود التنشؤ عالي الدرجة PIN HG في الخزع %16.5- 1.5 وأظهرت الدراسات الواسعة أنّ خطر وجود السرطان في الخزعة التالية يتراوح من %35- 23، ولا يرفع PIN بحد ذاته PSA المصلي.
السرطان الغدي Adenocarcinoma) %95) :
يتوضع معظمها في المنطقة المحيطية في %70- 60 و%20- 10 في المنطقة الانتقالية، و%10- 5 من الحالات في المنطقة المركزية.
مجهرياً: يتميز بغياب طبقة الخلايا القاعدية على الرغم من أنها موجودة في الغدة الطبيعية، وفرط التنسج الموثي السليم والآفات ما قبل السرطانية.
تكون السرطانة الغدية متعددة البؤر في أكثر من %85 من الحالات، وتبدي %50 من حالات السرطان الغدي تمايزاً صماوياً عند التقييم النسيجي الكيماوي المناعي.
سرطان الخلايا الصغيرة :
مماثل لما هو في الرئة، ولا يبدي فعالية هرمونية، ويترافق في %50 من الحالات مع السرطان الغدي، ومعدّل البقيا في هذه الحالات أقل من سنة واحدة.
السرطانة شائكة الخلايا SCC:
نادرة مع معدل بقيا منخفضة، وتؤدي لنقائل حالّة للعظم ولا تستجب للعلاج بالحرمان الهرموني.
أورام اللحمة المتوسطة:
تشكل %0.2- 0.1 من تنشّؤات الموثة.
- الغرن العضلي المخطط: وهو الأشيع، ويشاهد في مرحلة الطفولة.
- الغرن العضلي الأملس: وهو الأشيع عند البالغين وتشاهد حالات منه عند تجريف الموثة TURP.
سرطان الخلايا الانتقالية:
تشكل %4- 1 من مجمل سرطانات الموثة، وتميل إلى الإرتشاح إلى عنق المثانة في أكثر من %50 من الحالات، والأكثر شيوعاً هو ترافقه مع قصة سرطان مثانة معالج من أشهر أو سنوات مع معالجة كيماوية داخل المثانة.
%45-35 من حالات استئصال المثانة والموثة من أجل سرطان المثانة تظهر وجود ارتشاح في الموثة.
يمكن أن يحدث ارتشاح للموثة في اللمفوما، وبشكل نادر جداً يمكن أن تكون بدئية فيه، ويمكن أن يحدث ارتشاح للموثة في ابيضاض الدم أيضاً.
نماذج انتشار سرطان البروستات
- الامتداد المباشر:
إلى كل من الحويصل المنوي، الارتشاح خارج المحفظة، المثلث المثاني وبشكل نادر المستقيم.
- النقائل اللمفية:
تواترها أقل من %10 وأكثر ما تغزو العقد اللمفية السادة والعقد الحرقفية الأصلية وأمام العجز وحول الأبهر.
- النقائل البعيدة:
تغزو معظمها العظام %90 وهي بشكل نموذجي بانية للعظم، ومواقعها بالترتيب التنازلي هي: الشوك القطني، الجزء القريب من الفخذ، الحوض، الفقرات الصدرية، الأضلاع، القص، الجمجمة والعضد.
أما الباقي %10 فهي حشوية إلى الرئة والكبد وبشكل نادر إلى الكظر.
الدرجة و المرحلة في سرطان البروستات
يُعتبر نظام غليسون Gleason لتحديد درجة الورم هو النظام الأكثر استخداماً في الولايات المتحدة الأمريكية، وهو يعتمد على مظهر البناء الغدي تحت التكبير الضعيف، ويصنف إلى خمس درجات هي:
- تتميز الدرجتان 1 و2 بالغدد الصغيرة المنسجمة والممتلئة بإحكام، واللحمة الداخلية بينها قليلة.
- تتميز الدرجة 3 بالغدد متغيرة الحجم والتي تتوضع ضمن لحمة طبيعية.
- تتميز الدرجة 4 بمظاهر نسيجية عديدة والصفة الواسمة هي تشكل غير كامل للغدد، وتبدو الغدد أحياناً مندمجة ومشتركة بحافة خلوية، وأحياناً أخرى نرى أعشاش خلوية أو حبال خلوية طويلة.
- أما الدرجة 5 ففيها خلايا مرتشحة وحيدة بدون تشكل غدّي أو ظهور لمعات.
تنتج نقاط غليسون Gleason score عن جمع درجتي غليسون الأكثر مشاهدة في العينة، ويتراوح مجموع نقاط غليسون بين اثنتين وعشرة.
يكون مجموع نقاط غليسون بين 4-2 في الأورام جيدة التمايز، وبين 6-5 في الأورام متوسطة التمايز، وبين 10-8 في الأورام سيئة التمايز.
يستخدم تصنيف TNM نتائج كلاًً من المس الشرجي DRE والايكو عبر المستقيم TRUS، بغض النظر عن نتائج الخزعة وذلك في تحديد المرحلة staging لسرطان الموثة.
تشخيص سرطان البروستات
المس الإصبعي عبر الشرج DRE :
غير نوعي وغير حساس لوحده، ويرجّح عدم انتظام الموثة وجود سرطان موثة في %50 من الحالات، بينما لا ينفي المس الإصبعي الشرجي الطبيعي وجود سرطان موثة.
يكون لدى المرضى المشخّص لديهم سرطان موثة بالمس الإصبعي الشرجي لوحده غزو للمحفظة في أكثر من ثلثي الحالات.
ويجب إجراء الخزعة عند الشك بال DRE بغض النظر عن قيمة المستضد الموثي النوعي PSA، لأن هذه القيمة تكون أقل من 4 نانوغرام/مل عند %25 من مرضى سرطان الموثة.
تخطيط الصدى عبر المستقيم TRUS :
يظهر السرطان بشكل كلاسيكي كآفة ناقصة الصدوية، لكن دراسة Flanigan أظهرت أن %18 فقط من الآفات المشتبهة بال TRUS كانت تحوي فعلياً على سرطان، في حين أن %65 من المناطق الحاوية على سرطان لم تكن مشتبهة بال TRUS.
ويفتقد حوالي %50-25 من السرطانات عند خزع المناطق ناقصة الصدوية فقط (سلبية كاذبة) لذا يجب إجراء الخزعة، وبغض النظر عن نتيجة TRUS عند كل مريض لديه اشتباه سريري أو بيوكيميائي بالسرطان بواسطة DRE أو PSA.
ملاحظة: TRUS غير حساس لتحري الامتداد الموضعي في حين أنّ بعض الخبراء يعتقدون بأنه يعطي تقييم أفضل للمراحل من DRE.
الواسمات الورمية:
الفوسفاتاز الحامضية الموثية Prostatic Acid Phosphatase:
هو الواسم التقليدي لسرطان الموثة، يرتفع عند %70 من المرضى الذين لديهم غزو خارج المحفظة أو عند وجود نقائل.
المستضد الموثي النوعي (Prostatic Specific Antigen (PSA:
هو غليكوبروتين يتركب من 240 حمض أميني، ومورثته على الصبغي 19.
- وفيزيولوجياً: يفرز بتركيز عالي في السائل المنوي، حيث يميّع الخثرة المنوية بعد القذف، ويتراوح نصف عمره من 2.2 إلى 2.3 يوم.
- القيمة الطبيعية: يصبح PSA قابلاً للمعايرة بعد سن البلوغ، وتمّ اقتراح القيمة العليا 4 نانوغرام/مل إلا أنّ القيمة الطبيعية تختلف بحسب العمر والعرق وحجم الموثة وشدة إفراز الأندروجين، وإنّ اعتماد قيمة عليا أقل من 4 نانوغرام/مل سيؤدي إلى تشخيص أكثر للسرطان، كما أنّ %25 من المرضى بسرطان الموثة يكون PSA أقل من 4 نانوغرام/مل (تقترح قيمة PSA من 10-4 نانوغرام/مل احتمال وجود سرطان بنسبة من %25-16، في حين إذا كانت قيمة ال PSA أكبر من 10 نانوغرام/مل فإنّ احتمال وجود السرطان يصل حتى %67).
- PSA ليس نوعياً لسرطان الموثة فيمكن أن يرتفع في عدة حدثيات مرضية:
- ضخامة الموثة السليمة BPH.
- التهاب الموثة.
- المنابلات عبر الإحليل.
- تمسيد الموثة.
- خزعة الموثة.
- بعد القذف مما يؤدي إلى إيجابية كاذبة.
- على الرغم من القيمة التنبؤية العليا لهذا المُشعر إلّا أنه لا يغني عن DRE لأنه كما ذكرنا فإن %25 من المرضى بسرطان الموثة لديهم PSA أقل من 4نانوغرام/مل.
- فمشاركة PSA مع DRE الأكثر فائدة لتشخيص سرطان الموثة.
- عند استعمال PSA لوحده يؤدي الى كشف السرطان في %18 من الحالات وعند استعمال DRE لوحده يؤدي إلى عدم تشخيص السرطان في %45-23 من الحالات.
- وجد أن %90-80 من السرطانات المشخصة بارتفاع PSA تكون هامة من حيث الحجم والدرجة.
خزعة الموثة:
تُعتبر خزعة الموثة الإجراء المثالي لتشخيص سرطان الموثة، وتُجرى بشكل نموذجي خزعة سداسية عبر المستقيم إما بالتوجيه الإصبعي أو بتوجيه الأمواج فوق الصوتية.
أظهرت الخبرة في السنوات الأخيرة أنّ الخزعة السداسية ليست كافية من أجل تحديد السرطانات التي يكون حجمها أقل من 0.5 سم3.
إنّ النموذج ثُماني العينات الذي نُصح به prest i عام 2000 هو أكثر فائدة، وينقص من احتمال إعادة الخزعة، وهناك نموذج نصح به Karakiewicz بأخذ خزعة لكل 5 سم3 من حجم الموثة.
استطبابات الخزعة الرئيسية :
تعتمد استطبابات الخزعة بشكل رئيسي على عمر المريض وحالته العامة، فمن عمر 45 سنة حتى 75 سنة تستطب الخزعة عند المرضى الذين لديهم فعلياً ارتفاع في قيمة PSA والذين لديهم موجودات مشتبهة بالمس الإصبعي الشرجي.
أمّا المرضى الأكبر سناً الذين لديهم موجودات مشتبهة بالمس الشرجي، فالخزعة يجب أن تُجرى لهم فقط عندما تكون مفيدة في توجيه العلاج، وفي غير هذه الحالة يُفضل عدم إجراء الخزعة لتجنّب الضغط النفسي الناجم عن تشخيص السرطان.
ويصل معدل السلبية الكاذبة عند إجراء الخزعة السداسية النظامية %30-12.
استطبابات إعادة الخزعة:
تتراوح الفترة الزمنية الفاصلة بين الخزعة الأولية والمُعادة من 6 أسابيع إلى سنة، وتتم إعادة الخزعة في الحالات التالية:
- إذا كانت هناك خزعة أولية سلبية على الرغم من موجودات DRE مشككة، أو ارتفاع سرعة PSA لأكثر من 0.75 نانوغرام/مل/سنة.
- إذا كانت نسبة PSA الحر أقل من 0.18.
- بوجود التنشّؤ داخل البشرة عالي الدرجة HG PIN بالتشريح المرضي، إذ تبلغ نسبة وجود السرطان في الخزعة في هذه الحالة %50-30.
تقنية الخزعة:
إنّ الخزعة المجراة عبر الشرج بتوجيه الأمواج فوق الصوتية هي الطريقة المختارة، وهي تجرى عادة باستخدام إبرة ذات قطر 18 gauge وهذه الإبرة الرفيعة تنقص معدل الاختلاطات، وتؤمن الحصول على عينات بطول 19-17 ملم، علماً أن هذا الطول يعتبر غير كافِ إذا كانت الموثة كبيرة الحجم، ومن أجل الحصول على عينات أطول فإن الإبر المستخدمة في هذه الحالة يمكن أن تنكسر بسهولة.
يعتمد معدل الكشف عن سرطان الموثة على عوامل متنوعة من بينها:
- عدد العينات المأخوذة .
- اختلاف توزع أمكنة أخذ العينات النسيجية .
- حجم الغدة .
يمكن كشف عدد أكبر من الآفات السرطانية بشكل واضح في الغدد التي حجمها أقل من 50 سم3، قياساً إلى الغدد التي حجمها أكبر من 50 سم3، وهذا يستدعي منطقياً أخذ عدد أكبر من العينات من الغدد كبيرة الحجم.
خزعة المنطقة الانتقالية والحويصلين المنويين:
إنّ خزعة المنطقة الانتقالية الموثية ليس لها أهمية في الفحص المبدئي، وإنما يجب أن تؤخذ هذه الخزعة كإجراء إضافي أثناء الخزعة المعادة، علماً أن احتمال إيجابية النتيجة يكون متدنياً عندما تؤخذ الخزع فقط من المنطقة الانتقالية %1-0.6.
تفيد خزعة الحويصلين المنويين في المرضى الذين لديهم قيمة PSA > 15 نانوغرام/مل، ويصل احتمال وجود غزو للحويصل المنوي عند هؤلاء المرضى إلى حوالي %28-20.
لا يملك حجم الورم الذي تتضمنه الخزع قدرة تنبؤية كافية عن الحجم الكلي للورم، ولكن يمكن للعدد الكبير للخزع الإيجابية التنبؤ عن حجم ورم كبير في الغدة.
الدراسات الشعاعية:
المسح العظمي Bon scan:
إنّ المكان الأكثر شيوعاً لتوضّع نقائل سرطان الموثة هو العظام.
ويعتبر تصوير الهيكل العظمي التقليدي Conventional Radiography وسيلة غير حساسة، حيث يتطلب أن يستبدل %50 من كثافة العظم بالورم، وأن يكون بقطر أكبر من 15-10 ملم حتى يمكن تحديده على صورة الهيكل العظمي، وهو يجب أن يُجرى فقط من أجل المرضى الذين لديهم موجودات مشتبهة بالفحص العظمي.
أما المسح العظمي فهو وسيلة أكثر حساسية لتحري النقائل العظمية، وتبلغ السلبية الكاذبة %8، وأظهرت الدراسات العديدة أنّه يمكن إهمال المسح العظمي إذا كانت قيمة PSA < 10 نانوغرام/مل، وبغياب الألم العظمي.
التصوير بالرنين المغناطيسي عبر المستقيم Endorectal coli MRI :
تتراوح دقته ما بين %92-51 وهو يتعلق بالفاحص، ويحتاج إلى دقة وخبرة، ولا تزال الكلفة المادية لهذه التقنية عالية، لذا يجب أن يبقى استخدامه محدوداً حتى يتبين أن هذه الطريقة هي الأفضل لتحديد مرحلة الورم
التصوير الطبقي المحوري المحوسب والمرنان CT scan & MRI:
يتم إجراء CT scan & MRI لنفي وجود نقائل إلى العقد اللمفية وذلك عند المرضى ذوي الخطورة العالية الذين يعتقد أنهم مرشحّون للمعالجة الحاسمة، سواءاً كانت الجراحة أو التشعيع، إلاّ أنّ هذا التصوير مكلف وحساسيته محدودة %40-30.
وهناك عدة معايير يمكن استخدامها لتحديد المرضى الذين يحتاجونه وهي تتضمن:
- سرطان مرحلة T3.
- مقدار PSA أكثر من 20 نانوغرام/مل.
- الدرجة البدئية للسرطان حسب غليسون هي 4 أو 5.
علاج سرطان البروستات
استئصال البروستات الجذري مع تجريف العقد الحوضية ثنائي الجانب.
تجريف العقد الحوضية ثنائي الجانب Bilateral pelvic lymphadenectomy:
يجري عادة بالتزامن مع استئصال الموثة الجذري، وفي الحالات التي يكون فيها احتمال عالٍ لإيجابية العقد اللمفاوية (كمجموع غليسون > 7، أو PSA > 10 نانوغرام/مل) ينتظر معظم الجراحين نتيجة الخزعة المجمّدة قبل الاستئصال الجذري.
وبالمقابل يجري معظم الجرّاحين استئصال الموثة الجذري بدون انتظار نتيجة الخزعة المجمدة عندما يكون PSA < 10 نانوغرام/مل ومجموع نقاط غليسون < 6، وعلى كل حال لقد أنقصت وسائل الاستقصاء المتقدمة وبشكل واضح احتمال وجود عقد لمفية إيجابية وقت العمل الجراحي، ويُجرى تجريف العقد اللمفية في بعض المراكز بشكل مستقل، إما جراحياً أو عبر تنظير البطن.